Natriumkanäle: Wirkort vieler Arzneistoffe



Natriumkanäle spielen eine vielfältige Rolle in der (Patho-)Physiologie vieler Erkrankungen, unter anderem bei epileptischen Anfällen. / © Shutterstock/Madrolly
Von Lokalanästhetika und Antiarrhythmika sowie manchen Antiepileptika wissen wir seit Langem, dass sie mit den spannungsabhängigen Natriumkanälen in Wechselwirkung treten, um den Natriumeinstrom zu blockieren und damit ihre Wirkung zu entfalten. Bislang sind neun Kanaltypen bekannt, die an verschiedenen Organsystemen lokalisiert sind und eine ähnliche Grundstruktur haben – mit geringfügigen, aber wichtigen Unterschieden. Diese Details kann man zur Entwicklung selektiver Arzneistoffe nutzen. Die Struktur der Natriumkanäle, ihre Aktivierung und die Wirkweise der interagierenden Arzneistoffe werden hier dargestellt.
Der Ablauf eines Aktionspotenzials ist mit Schwellenspannung, Depolarisation (Na⁺-Einstrom), Repolarisation (K⁺-Ausstrom), Hyperpolarisation und wieder Ruhepotenzial schon lange bekannt. Dagegen wurden die strukturellen Details der Natriumkanäle und ihre Funktionsweise erst in den letzten Jahren durch kryo-elektronenmikroskopische und Moleküldynamik-Untersuchungen erforscht.
Die Natriumkanäle (Nav) gehören zur Superfamilie der spannungsabhängigen (voltage-gated) Kationenkanäle, wie auch Kv und Cav-Kanäle.
Prinzipiell bestehen die komplex aufgebauten, aus etwa 2000 Aminosäuren bestehenden Natriumkanäle aus einer α-Einheit, die aus vier miteinander verbundenen, nicht identischen, aber homologen Domänen (DI bis DIV) besteht. Jede Domäne besteht wiederum aus sechs miteinander verbundenen transmembranären Segmenten (S1 bis S6), wobei S1 bis S4 spannungsempfindliche Module (voltage-sensing domains VSD1 bis VSD4) sind und S5 und S6 eine zentrale Pore bilden (Porenmodul PM) (1). Dabei sind S4 und S5 über einen Linker miteinander verbunden. Die Abbildung 1 zeigt den komplizierten Aufbau anschaulich. S5 und S6 sind über einen extrazellulären Haarnadel-Loop miteinander verbunden, der den Ionenkanälen den Namen P-Loop-Kanäle gegeben hat.
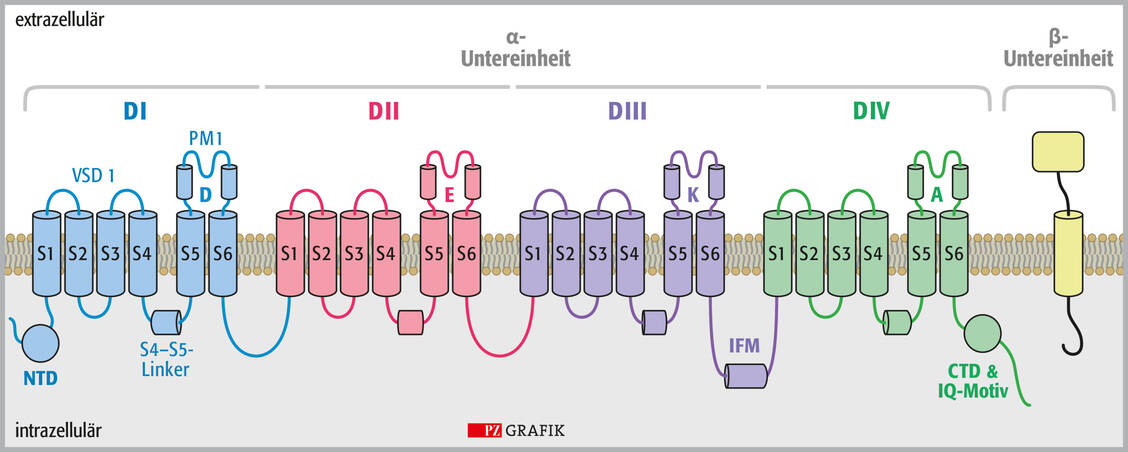
Abbildung 1A: Schematische Darstellung des humanen Nav-Kanals; links die α-Untereinheit mit den Domänen DI bis DIV und den Segmenten S1 bis S6; rechts (gelb gezeichnet) die β-Untereinheit. CTD: Carboxyl-terminale Domäne; D: Domäne; IFM: Fast inactivation peptide, Peptid, das für die schnelle Inaktivierung verantwortlich ist; IQ-Motiv: Calmodulin-Bindemotiv; PM: Porenmodul; NTD: N-terminale Domäne; S: transmembranäres Segment; VSD: spannungsempfindliche Module, voltage-sensor domain / © PZ/Stephan Spitzer
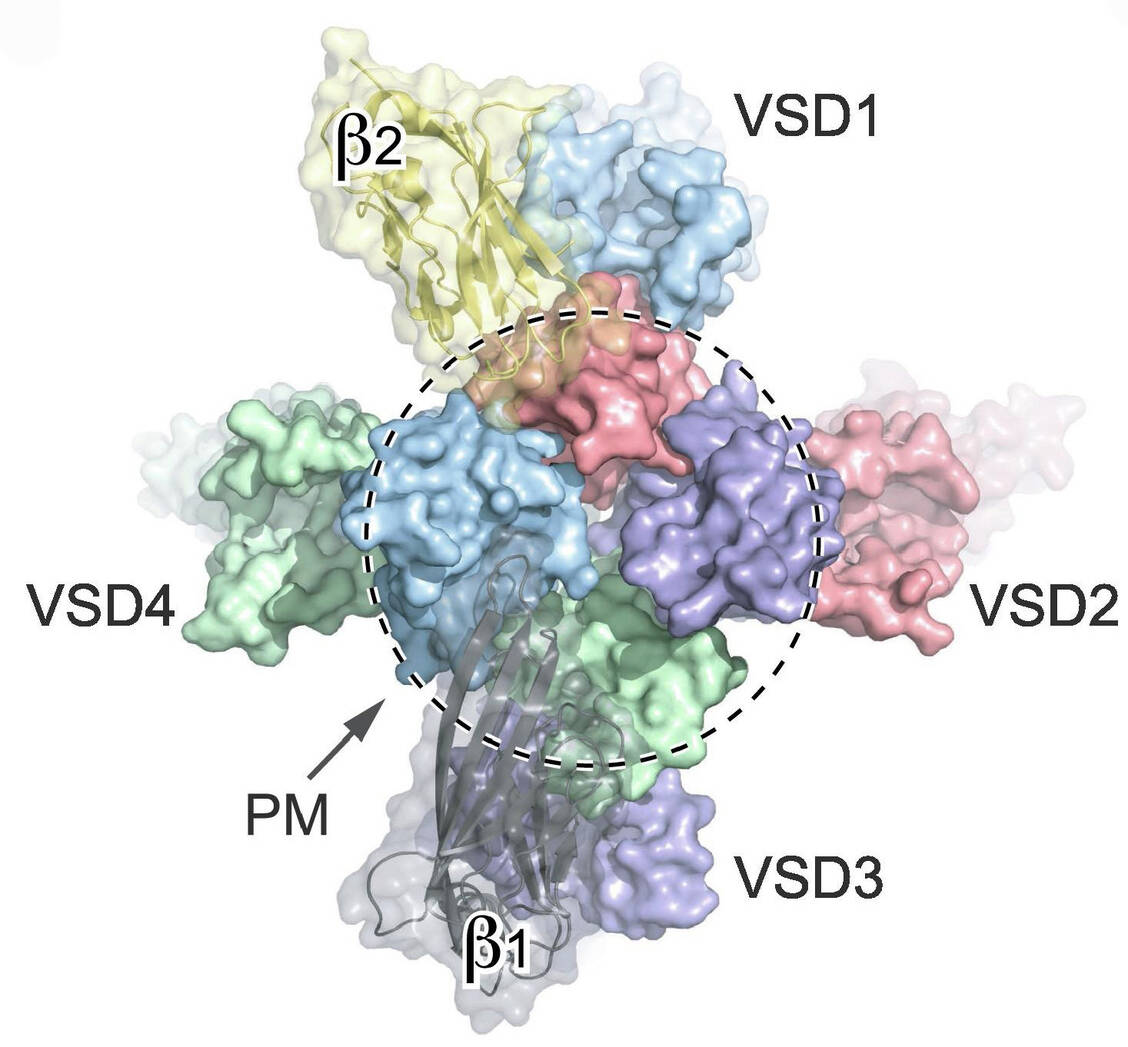
Abbildung 1B: Extrazellulärer Blick auf den humanen Nav1.7-Kanal (Protein Data Bank, PDB: 6J8J); in der Mitte die Pore (PM) und an den vier Ecken die spannungsempfindlichen Domänen (VSD) und die β-Untereinheit; alle Teile haben dieselben Farben wie in Abbildung 1A. / © PDB
Die vier spannungsempfindlichen Module sind an den Ecken der zentralen Pore lokalisiert. Die VSD4-Untereinheit weist ein Motiv mit positiv geladenen Argininen auf. Im Ruhezustand des Kanals sind diese positiv geladenen Aminosäuren durch das negative Membranpotenzial einwärtsgerichtet. Kommt es zur Depolarisation, bewegen sich diese Aminosäuren nach außen und bilden mit negativ geladenen Aminosäuren in den S1- bis S3-Untereinheiten Ionenpaare, sodass der Ionenkanal geöffnet wird.
An diesem Prozess sind die Porenmodule S5 und S6 beteiligt (Abbildung 1). Diese bestehen aus
- einem extrazellulären Vestibül, das mit der β-Einheit in Kontakt steht und den ganzen Aktivierungsprozess beeinflusst;
- einem Ionenselektivitätsfilter, der zwischen Natrium-, Kalium- und Calciumionen unterscheiden kann. Ein DEKA-Motiv (Asp, Glu, Lys, Ala) umsäumt den Filter, sodass hydratisierte Natriumionen gebunden werden und später passieren können. Hydratisierte Calciumionen sind zu groß und Kalium zu wenig hydratisiert, sodass Letztere aufgrund ihrer konzentrierten Ladung am Filter hängen bleiben;
- einer zentralen, hoch konservierten Kavität, in die Arzneistoffe gelangen, damit den Kanal blockieren und den Natrium-Einwärtsstrom antagonisieren;
- einem Aktivierungstor (S6) am intrazellulären Ende der Pore. Bei Deaktivierung der VSD bewegt sich die S4-Helix 7 Å einwärts und der S4-S5-Linker verschließt das Tor. Dann können die Natriumionen zwar noch in die zentrale Kavität, aber nicht mehr in die Zelle gelangen. Bei Aktivierung verläuft der Prozess umgekehrt. Ein Iso-Phe-Met-Motiv im DIII-DIV-Linker kann den Inaktivierungsprozess beschleunigen.

pharmazeutische-zeitung





